新工程细菌可阻止抗生素副作用的发生
导读:虽然抗生素是拯救生命的药物,但它们也会伤害生活在人类肠道中的有益微生物。
虽然抗生素是拯救生命的药物,但它们也会伤害生活在人类肠道中的有益微生物。在抗生素治疗后,一些病人有可能出现炎症或机会性感染如艰难梭菌。对肠道微生物不加区分地使用抗生素还会导致抗药性的扩散。
为了减少这些风险,麻省理工学院(MIT)的工程师们开发了一种新方法来帮助保护人类消化道的自然菌群。他们采用了一株可供人类安全食用的细菌并对其进行了改造进而使其能安全地产生一种酶。据悉,这种酶可以分解一类被称为β-内酰胺类的抗生素。这些药物包括氨苄西林、阿莫西林和其他常用药物。
研究人员在对小鼠的研究中发现,当这种“活体生物疗法”跟抗生素一起使用时,它可以保护肠道中的微生物群且能让血液中循环的抗生素水平保持高位。
麻省理工学院(MIT)医学工程与科学研究所(IMES)和生物工程系的Termeer医学工程与科学教授、这项研究的论文第一作者James Collins指出:“这项工作表明,可以利用合成生物学来创造一类新的工程治疗剂以减少抗生素的不良影响。”
据悉,这项研究的作者还有IMES和哈佛大学Wyss生物启发工程研究所的研究科学家Andres Cubillos-Ruiz、MIT研究生Miguel Alcantar和Pablo Cardenas、怀斯研究所工作人员科学家Nina Donghia及博德研究所研究科学家Julian Avila-Pacheco。
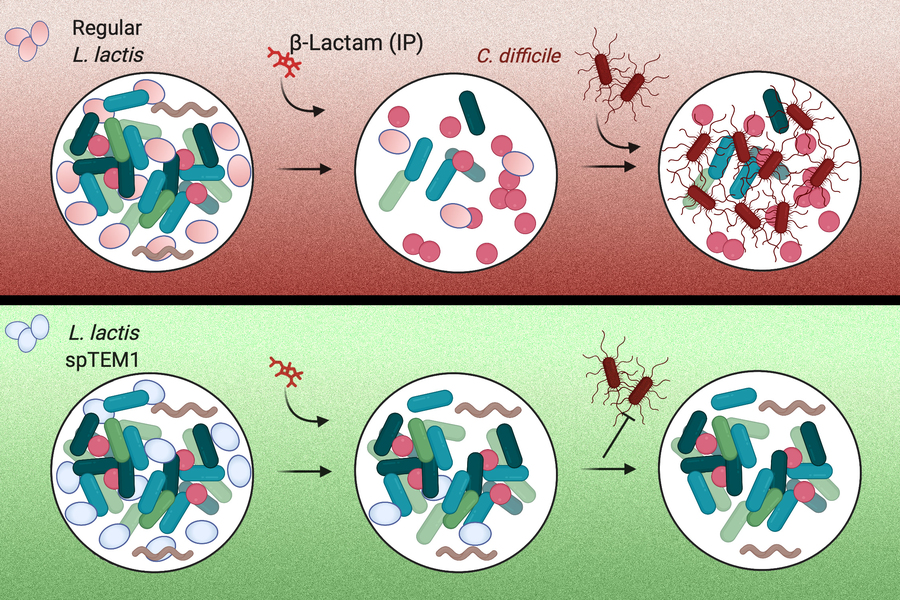
保护肠道
在过去的二十年里,研究表明,人类肠道中的微生物不仅在新陈代谢中发挥着重要作用,而且在免疫功能和神经系统功能中也发挥着重要作用。
Cubillos-Ruiz表示:“在你的一生中,这些肠道微生物集合成一个高度多样化的社区,在你的身体中完成重要的功能。当药物或特定种类的饮食等干预措施影响到微生物群的组成并创造一个改变的状态时,问题就来了,这被称为菌群失调。一些微生物群体消失,而其他微生物的代谢活动增加。这种不平衡可能会引发各种健康问题。”
可能发生的一个主要并发症是感染艰难梭菌,这种微生物通常生活在肠道中但通常不会造成伤害。然而当抗生素杀死跟艰难梭菌竞争的菌株时,这些细菌就会接管并导致腹泻和结肠炎。艰难梭菌每年在美国感染约50万人并导致约15000人死亡。
医生有时会给服用抗生素的人开益生菌(有益细菌的混合物),但这些益生菌通常也容易受到抗生素的影响,并且它们不能完全复制肠道中发现的本地微生物群。
“标准益生菌不能跟本地微生物所具有的多样性相比。它们不能完成跟你一生中培养的本地微生物相同的功能,”Cubillos-Ruiz说道。
为了保护微生物群不受抗生素影响,研究人员决定使用改性细菌。他们改造了一株叫做乳酸菌的细菌,它通常用于奶酪生产并可提供一种分解β-内酰胺类抗生素的酶。这些药物在美国的抗生素处方中占了大约60%。
当这些细菌被口服时,它们会暂时在肠道内繁殖,在那里它们会分泌一种叫做β-内酰胺酶的酶。这种酶然后分解到达肠道的抗生素。当口服抗生素时,药物主要从胃部进入血液,所以药物仍可以在体内高浓度循环。这种方法还可以跟注射的抗生素一起使用,这些抗生素最终也会到达肠道。在完成工作后,工程细菌会通过消化道排出体外。
使用可降解抗生素的工程菌带来了独特的安全要求。β-内酰胺酶将抗生素耐药性赋予包庇的细胞,其基因很容易在不同的细菌之间传播。为了解决这个问题,研究人员使用了一种合成生物学方法,其对细菌合成酶的方式进行重新编码。他们将β-内酰胺酶的基因分解成两块,每块都编码了该酶的一个片段。这些基因片段位于不同的DNA片段上,这使得两个基因片段都转移到另一个细菌细胞中的可能性非常小。
这些β-内酰胺酶片段被输出到细胞外,在那里它们会重新组合并恢复酶的功能。由于β-内酰胺酶现在可以在周围环境中自由扩散,它的活动成为肠道细菌群落的“公共产品”。这防止了工程细胞获得对本地肠道微生物的优势。
Cubillos-Ruiz说道:“我们的生物封闭策略使抗生素降解酶能够被输送到肠道,但不会有横向基因转移到其他细菌的风险也没有被活体生物治疗剂获得额外的竞争优势。”
保持微生物的多样性
研究人员为了测试他们的方法给小鼠注射了两次口服的工程菌,每次注射氨苄青霉素。工程细菌进入肠道并开始释放β-内酰胺酶。在这些小鼠中,研究人员发现,血液中循环的氨苄西林的数量跟没有接受工程细菌的小鼠一样高。
在肠道中,跟只接受抗生素的小鼠相比,接受工程细菌的小鼠保持了更高的微生物多样性水平。在这些小鼠中,微生物多样性水平在它们接受氨苄青霉素后急剧下降。此外,没有一只接受工程细菌的小鼠发生机会性艰难梭菌感染,而所有只接受抗生素的小鼠在肠道中显示出高水平的艰难梭菌。
Cubillos-Ruiz指出:“这是一个强有力的证明,这种方法可以保护肠道微生物群并与此同时保留抗生素的功效,因为你没有改变血液中的水平。”
研究人员还发现,消除抗生素治疗的进化压力使肠道微生物在治疗后产生抗生素抗性的可能性大大降低。相比之下,他们在接受抗生素治疗但没有接受工程细菌治疗的小鼠体内存活的微生物中发现了许多抗生素抗性基因。这些基因可以传递给有害细菌,进而让抗生素耐药性问题发生恶化。
研究人员现在计划开始开发一个治疗方法版,它可以在患急性疾病的高风险人群中进行测试,而这些疾病源于抗生素引起的肠道菌群失调,他们希望最终可以用来保护任何需要服用抗生素治疗肠道外感染的人。
“如果肠道内不需要抗生素的作用那么你就需要保护微生物群,”Cubillos-Ruiz说道,“这类似于当你接受X光检查时,你穿上铅围裙以保护你身体的其他部分免受电离辐射的影响。以前没有任何干预措施可以提供这种程度的保护。通过我们的新技术,我们可以通过保留有益的肠道微生物和减少新的抗生素耐药变体出现的机会使抗生素变得更加安全。”