首个国产新冠口服药诞生,百亿市场能否如期兑现?
导读:7月25日,国家药监局发布通知,称根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准河南真实生物科技有限公司阿兹夫定片增加治疗新冠病毒肺炎适应症注册申请。
让人翘首以盼的国产新冠口服药,终于迎来重大利好消息。
7月25日,国家药监局发布通知,称根据《药品管理法》相关规定,按照药品特别审批程序,进行应急审评审批,附条件批准河南真实生物科技有限公司阿兹夫定片增加治疗新冠病毒肺炎适应症注册申请。
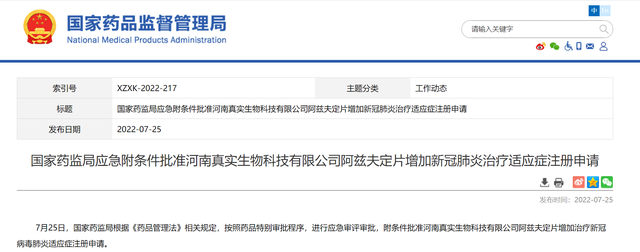
该药品是我国自主研发的口服小分子新冠病毒肺炎治疗药物。2021年7月20日,国家药监局已附条件批准本品与其他逆转录酶抑制剂联用治疗高病毒载量的成年HIV-1感染患者。此次为附条件批准新增适应症,用于治疗普通型新型冠状病毒肺炎成年患者。
国家药监局要求上市许可持有人继续开展相关研究工作,限期完成附条件的要求,及时提交后续研究结果。
至此,首款国产新冠口服药归属靴子落地。在开拓药业、君实生物/旺山旺水、真实生物等一众药企争夺的新冠口服药市场,真实生物暂时处于领先地位。
未批先红的阿兹夫定片
新冠口服药,一直被视为药企弯道超车的机会点。根据药融云数据统计,截至五月初全球在研新冠药物共有1200余个,IND及以上研发阶段的项目占比近50%。相较于需注射给药的瑞德西韦和中和抗体药物,这一赛道也悄然走热。西南证券曾估算全球口服新冠药物市场规模达百亿美元。
在国产新冠口服药的竞赛中,君实生物的VV116、开拓药业的普克鲁胺、真实生物的阿兹夫定片三者研究进度远远领先于同类企业。而阿兹夫定片则赚足了眼球,7月15日真实生物宣布其治疗新型冠状病毒肺炎适应症注册Ⅲ期临床试验结果达到预期,引得社交媒体的众多喝彩。
事实上,阿兹夫定片的网红之路始于艾滋病。作为我国自主知识产权的首个双靶点抗艾滋病药物,该药品于2021年7月通过优先审评审批程序,获附条件批准上市。其与核苷逆转录酶抑制剂及非核苷逆转录酶抑制剂联用,用于治疗高病毒载量(HIV-1 RNA≥100000 copies/ml)的成年HIV-1感染患者。
因为新冠病毒与人类免疫缺陷病毒同属于RNA病毒,它们的蛋白酶有一定的相似性。2020年新冠疫情爆发之后,一项名为“阿兹夫定片治疗新型冠状病毒感染肺炎(COVID-19)的随机、开放、对照临床试验”在中国临床实验中心注册成功。
阿兹夫定药物发明人、郑州大学副书记、副校长常俊标教授在Nature子刊发表的论文揭晓了这个药物的临床试验研究结果——在实验组10例患者当中,4天内第一次核酸转阴率达到90%,相较而言,常规治疗组4天内第一次核酸转阴率仅仅10%。
他曾公开表示:“阿兹夫定作为一种抑制病毒RNA依赖性RNA聚合酶(RdRp)的核苷类似物,能特异性作用于新冠病毒RdRp,从而抑制病毒复制,其药物靶向性强。”
在关键Ⅲ期注册临床试验中,阿兹夫定片可显著缩短中度的新型冠状病毒感染肺炎患者症状改善时间,首次给药后第7天临床症状改善的受试者比例阿兹夫定组40.43%。其具有抑制新冠病毒的活性,病毒清除时间为5天左右。
2022年中国医药发展大会中,中国工程院院士、中国医学科学院北京协和医学院药物研究院院长蒋建东透露,阿兹夫定每日仅口服5mg,而瑞德西韦每日需要注射100mg。且临床效果要优于瑞德西韦,但在抗重症效果上略有逊色。
新华制药、华润双鹤、奥翔药业已经开始抢夺真实生物这块香饽饽了,与其达成合作,意图在新冠口服药市场中分一杯羹。此前,真实生物已分别与他们签订了阿兹夫定的委托生产协议及战略合作协议。
但是预期之高的新冠口服药,能否成为下一个印钞机仍待存疑。在第九版新冠诊疗方案里,轻型和普通型患者治疗采用中药,而新冠口服药和中和抗体,几乎只用于“高危因素”的人群。
而上海复旦大学附属华山医院张文宏教授和马昕教授领衔的大样本数据研究首次揭示,非高危组奥密克戎患者重症率为零。在今年3月22日至5月3日期间的33816名早期非重症奥密克戎感染者,最后有22人进展为重症,总体重症率为0.065%(22/33816)。新冠口服药的市场空间或不如想象乐观。
以辉瑞的新冠口服药Paxlovid为例,2022年一季度,Paxlovid的销售额约为14.70亿美元,远低于此前市场预测的24.20亿美元。GlobalData分析师Camila Dalitz公开评论道:“在2022年达到顶峰之后,在第二轮疫苗加强注射和预计需要住院的病例减少之后,Paxlovid的销售额将从2023年开始下降。”
获批只是一个开始,阿兹夫定要走的路还有很多。